¿Alguna vez pensaste en la posibilidad de que los microorganismos se comuniquen? Pues lo cierto es que lo hacen y los biofilms bacterianos tienen la respuesta. Pero no nos adelantemos.
Definiendo el concepto de biofilm o biopelícula bacteriana
Los biofilms bacterianos o biopelículas son comunidades de microorganismos que crecen en una matriz, adheridos a una superficie inerte o también a tejidos vivos.
El gran interés existente en conocer en profundidad todo lo relativo a la formación y características de los biofilms reside en que pueden jugar un papel importante en la persistencia de múltiples infecciones bacterianas.
De hecho, se estima que hasta el 80% de las infecciones bacterianas humanas son causadas por biopelículas bacterianas, que son extremadamente difíciles de curar, ya que las bacterias dentro de una biopelícula son varios órdenes de magnitud más resistentes a los antibióticos.
Llegados a este punto nos resulta de interés resolver dos incógnitas:
- Cuál es el factor que la ciencia indica como más relevante para la generación de biofilms bacterianos.
- Cómo se comunican las bacterias.
Formación de los biofilms bacterianos: la importancia de la percepción de quorum o quorum sensing
La percepción de quorum, es el mecanismo a través del cual las células evalúan la densidad de su población y, en caso de existir un número suficiente de las mismas, proceder a distintos tipos de respuestas adaptativas, entre las que se encuentra la generación de las biopelículas. No obstante, cabe destacar que esta es una hipótesis, aún sin total consenso científico, aunque es la más aceptada.
Este proceso de quorum sensing está mediado por unas moléculas denominadas autoinductores, las cuales también tienen diversos tipos, son secretadas por las propias bacterias y están presentes en los fluidos en los que se residen.
Cuando existe un volumen determinado de autoinductores (lo que indica una densidad de población suficiente), estas moléculas pasan al interior celular de las bacterias provocando distintos cambios a nivel genético, en el caso que nos ocupa, para la formación de biofilms bacterianos.
Otros efectos vinculados al quorum sensing pueden ser la esporulación o la expresión de factores de virulencia.
A destacar también, que hay autoinductores específicos por especies, así como también otros reconocibles por todo tipo de bacterias. En el microorganismo productor residirá la clave de que nos encontremos ante un tipo u otro de molécula.
Por todo ello, las estrategias naturales de detección de quórum han suscitado gran interés a nivel médico, ya que pueden abrir una vía para evitar la formación de biopelículas patogénicas o la expresión de factores de virulencia en determinadas bacterias.
Estructura de las biopelículas bacterianas
El concepto de poliscárido extracelular (o exopolisacárido) es el central en lo que a estructura de los biofilms se refiere. Este tipo de sustancias en forma de hebras largas o ramificadas, se sintetizan tanto de manera extracelular como intracelular y se secretan al exterior.
Podríamos hacer la analogía de que son como andamios formados para permitir se adhieran otras sustancias como carbohidratos, proteínas, ácidos nucleicos y lípidos.
Como curiosidad, destacar que, aunque la mayoría de los exopolisacáridos se secretan para la generación de biopelículas, se ha demostrado que algunos también pueden tener propiedades antiobilfm.
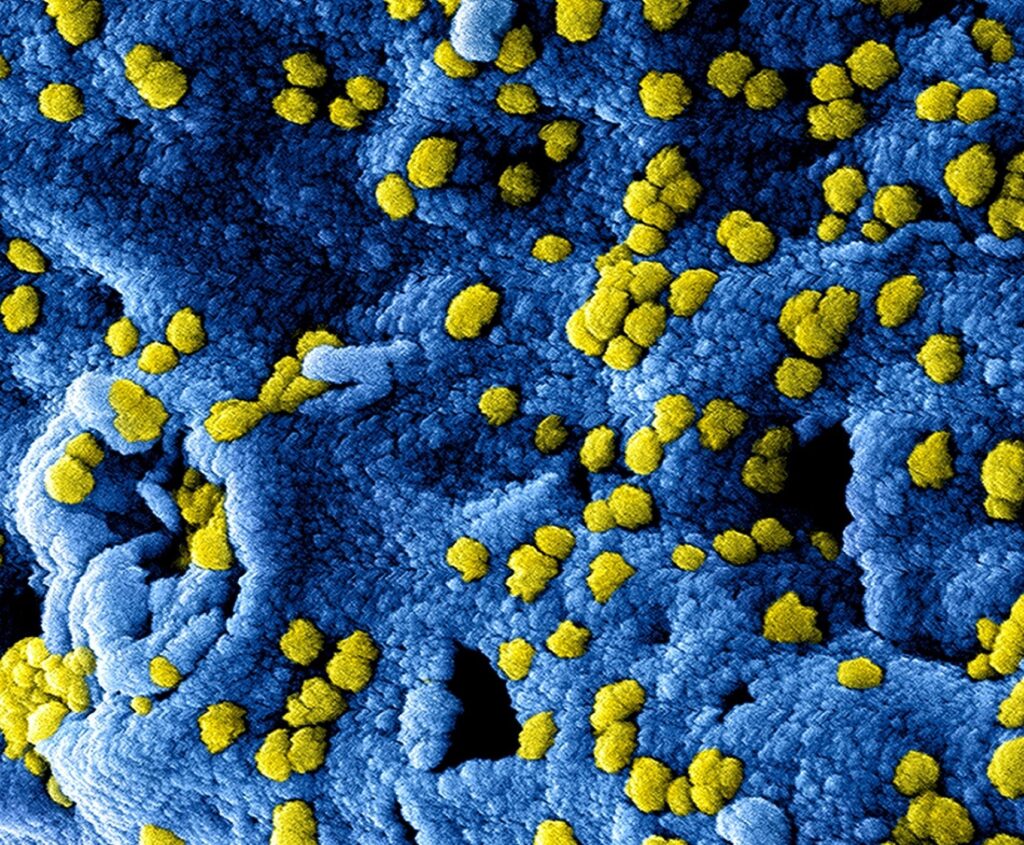
Otro componente importante, como citábamos anteriormente, son las proteínas extracelulares que ayudan tanto en la formación como en la estabilización de la biopelícula.
Finalmente, podemos destacar la importancia del ADN extracelular (eADN) secretado en muchas ocasiones por las propias bacterias y al cual se le considera fundamental para la fijación de la biopelícula.
Razón de ser y génesis de la formación de los biofilms bacterianos
Muchos investigadores defienden que el de biopelícula parece ser el estado natural y predominante de las bacterias y no el resultado de factores condicionantes. Sea como fuere, entre las características inherentes a la generación de biofilms, por favorecer la supervivencia de las bacterias residentes en los mismos, encontramos:
- Los canales existentes en la biopelícula permiten que el agua, el oxígeno y los nutrientes lleguen a todas las partes de la estructura.
- La matriz protege a las células residentes de la desecación o la perturbación química, así como la invasión de otras bacterias.
- Las propiedades mecánicas de la matriz la hacen resistente a distintos tipos de fuerzas externas. Podemos pensar aquí en la placa dental resistiendo al cepillado, por ejemplo.
- Al estar adheridas, las bacterias pueden evitar ser arrastradas por el flujo de agua o la sangre.
- El aumento de la densidad celular dentro de la biopelícula proporciona un entorno óptimo para el intercambio de ADN.
- Y como aspecto esencial, sobre el que ahondaremos en un apartado posterior, los biofilms bacterianos proveen de cierta protección contra los agentes antimicrobianos como, por ejemplo, los antibióticos.
Finalmente, destacar que las biopelículas tienen características diferentes dependiendo de las sustancias que la compongan, y de esa manera pueden ser más o menos elásticas, tolerar mejor o peor el pH o tener una concentración de fluidos internos determinada.
Como último aspecto, destacar que las biopelículas pueden tener alta, media o baja densidad de celular o combinar varias de ellas.
La dispersión de las biopelículas bacterianas
Otro aspecto central en las investigaciones presentes y futuras sobre la lucha contra los biofilms patógenos, es el de la dispersión de los mismos.
A groso modo, podemos indicar que este proceso puede darse de forma natural, permitiendo que las bacterias escapen y colonicen nuevos nichos, cuando los nutrientes y otros recursos se vuelven limitados o, también, puede ser inducido por el hombre.
En cualquier caso, dejar de sintetizar compuestos de la matriz de la biopelícula, la degradación de la misma y la incapacidad de generar estructura, son los tres tipos de procesos más habituales en la dispersión de biofilms.
No obstante, nos queda aún mucho camino por recorrer en este sentido hasta tener un conocimiento tal, que nos permita tener herramientas efectivas en la lucha contra los biofilms bacterianos patógenos.
Enfermedades asociadas a la existencia de biopelículas
Como indicábamos al inicio, el creciente interés por los biofilms reside en que un gran porcentaje de las infecciones bacterianas se producen a raíz de la aparición de estos compuestos. Veamos algunos ejemplos:
– Infecciones pulmonares (fibrosis quística)
Esta es, con diferencia, la interacción entre biopelícula y patología más estudiada. En este caso, Pseudomonas aeruginosa centra todas las miradas. Se trata de una bacteria habitual en la naturaleza en las zonas húmedas (ríos, lagos, duchas, bañeras, piscinas…) y en el caso de los humanos, en axilas, conducto auditivo, región perineal o mucosas, por ejemplo.
Se estima que el 80% de los pacientes con esta patología están infectados de manera crónica por P. aeruginosa, cuyas biopelículas impiden la curación de la fibrosis quística, ya que los antibióticos solo alivian los síntomas, pero los reservorios en forma de biopelículas permiten la recurrencia de la enfermedad.
– Placa dental, caries, gingivitis y periodontitis
Las biopelículas tienen un papel preponderante en la salud oral. Como expusimos en el apartado del microbioma oral, más de 720 especies diferentes de microorganismos conviven en él.
En este sentido, es de destacar que los estudios han constatado que existen múltiples diferencias entre la placa dental sana y la placa dental disbiótica.
Un ejemplo de ello es que Streptococcus sobrinus y Streptococcus mutans, dos de las bacterias que más veces han sido aisladas en la microbiota oral y que son especies tolerantes a ambientes más ácidos, sobreviven generando biopelículas, las cuales están asociadas a las principales patologías orales como la caries o la periodontitis.
– Heridas crónicas
Las heridas crónicas están relacionadas con biopelículas persistentes que provocan cicatrizaciones más lentas y las cuales podemos encontrar tanto en las capas exteriores, como en las más profundas.
– Infección del tracto urinario
Aquí los sospechosos habituales serán Escherichia coli uropatógena, Klebsiella pneumoniae, Enterococcus faecalis o Proteus mirabilis.
Las infecciones por este tipo de bacterias patógenas suelen ir de la mano de catéteres que permiten la formación de biopelículas.
– Infección o endocarditis de la válvula cardiaca
Las especies bacterianas implicadas aquí suelen ser Staphylococcus epidermidis, Staphylococcus aureus, Streptococcus spp., Corynebacterium spp., Enterococcus spp. y Candida spp. (spp. = todas las especies de ese género).
Similar a lo que puede ocurrir en el tracto urinario. En este caso los biofilms se forman en la citada válvula, impidiendo su correcto funcionamiento. Este problema se puede ver agravado por la posibilidad de que las bacterias asociadas migren al torrente sanguíneo.
– Otras enfermedades asociadas a los biofilms
La otitis media (Streptococcus pneumoniae), la amigdalitis o la fascitis necrotizante (Estreptococos del grupo A), la osteomielitis (mediada por diversas especies bacterianas) y los cálculos renales infecciosos (provocados por diversos bacilos gramnegativos) son otros ejemplos de enfermedades en las que las biopelículas juegan un papel fundamental.
Resistencia y tolerancia a los antibióticos de los biofilms
En líneas generales, podemos decir que la resistencia bacteriana a los antibióticos está causada por mutaciones que hacen sea impermeable al efecto tóxico del antibiótico, dotando a esa célula y a sus descendientes de una ventaja de crecimiento selectivo sobre las células no resistentes.
Por tanto, la resistencia sería una capacidad perenne, mientras que la tolerancia, sería la capacidad de sobrevivir a una exposición transitoria a altas concentraciones de un antibiótico. Este concepto es el que se vincula a los biofilms.
Esta idea rompe en gran medida con la teoría, históricamente defendida, acerca del hecho de que exista una barrera física en la propia génesis del biofilm, y que esta sería la causante de que las bacterias que conviven en su interior sean más tolerantes al potencial antibiótico.
Lo cierto, es que investigaciones recientes han detectado que, si bien la matriz celular de las biopelículas sí que puede ofrecer cierta resistencia, no es cierto que el antibiótico no pueda acceder, ya que el tamaño de la malla de la biopelícula es mucho mayor que las moléculas de los antibióticos.
Por ello, la idea de que las bacterias propias de un biofilm tienen una fisiología alterada (en modo fase estacionaria), la cual puede conferirles esa mayor tolerancia a los tratamientos antibióticos, está tomando cada vez más importancia.
Aspectos implicados en la tolerancia a los antibióticos
No obstante, y volviendo al potencial de los biofilms, todos los parámetros considerados a día de hoy con impacto en la resistencia a los antibióticos de las bacterias presentes en la biopelícula son:
- Penetración limitada de los antibióticos por la matriz, como ya hemos comentado.
- La transferencia entre bacterias de genes resistentes a los antibióticos a través de plásmidos (pequeñas moléculas de ADN).
- Tasas de crecimiento celular reducidas dentro de los biofilms, que hacen que los antibióticos orientados a las células en división no tengan efecto.
- La existencia de células persistentes de crecimiento cero, por los mismos motivos del punto anterior.
- La existencia de las denominas bombas de eflujo bacterianas. Hablamos de una serie de proteínas presentes en la membrana celular, que van a permitir “drenar” las moléculas antibióticas del interior de la célula al exterior.
Por todo ello, parece que el espectro de lucha contra bacterias patógenas y, en especial, las asociadas a biopelículas, es mucho más amplio del que pudiera pensarse a priori.
Conclusiones
El de los biofilms es un campo de estudio fascinante que abre un nuevo universo en el espectro del microbioma.
La importancia del efecto patogénico de esta concentración de comunidades microbianas nos obliga a poner el foco en lograr avances científicos y médicos en este ámbito.
Por ello, el uso de compuestos antibiofilm no biocidas en la medicina, puede ser importante en el futuro, aunque todavía hay muchas incógnitas que resolver en los mecanismos de acción entre las estructuras y las propias biopelículas.
De hecho, yo me planteo algunas que no he podido resolver hasta la fecha:
- ¿Pueden los antibióticos promover la generación de biofilms provocando reacciones enfocadas a la supervivencia?
- ¿Y los probióticos por exceso de densidad de una especie determinada? ¿Y si así fuera, sería contraproducente la generación de esas biopelículas?
Sea como fuere, cabe recordar que no todos los biofilms son patogénicos y que la generación de los mismos puede estar en la propia génesis de los microorganismos y no como como una herramienta para dañar al huésped.
Aunque lo más importante es que ellas se comunican…
Aspectos clave sobre los biofilms bacterianos
¿Qué es el biofilm?
Un biofilm es una comunidad de microorganismos que crecen en una matriz adheridos a una superficie inerte o también a tejidos vivos. Tiene distintas características dependientes de las sustancias que lo compongan, en cuanto a elasticidad, densidad de fluidos o pH.
¿Qué hace el biofilm?
Si bien la función de un biofilm no debe ser necesariamente patógena, se estima que hasta el 80% de las infecciones bacterianas humanas son causadas por este tipo de biopelículas bacterianas, por lo que suelen ser uno de los principales problemas a abordar en el ámbito de múltiples patologías.
¿Dónde se encuentra el biofilm?
Un biofilm puede encontrarse en cualquier tipo de superficie, tanto inerte como viva. En el ser humano, los podemos encontrar en cualquier tipo de tejido vivo habiéndose estudiado con especial interés en el ámbito de la microbiota oral, en especial en su relación con patologías como la periodontitis.
¿Qué son las biopelículas bacterianas?
Las biopelículas bacterianas son la unión de múltiples microorganismos de una misma, o de varias especies, los cuales crecen en torno a una matriz común, la cual les permite aumentar su capacidad de supervivencia, entre otros aspectos.
¿Cómo se forma la biopelícula?
Se forma a partir de los denominados polisacáridos extracelulares, a los que se adhieren otras sustancias como carbohidratos, proteínas, ácidos nucleicos y lípidos. Todo ello está precedido por la percepción de quorum bacteriana, el mecanismo a través del cual las células evalúan la densidad de su población y generan respuestas adaptativas.
¿Qué función tienen las biopelículas?
En el contexto bacteriano, las biopelículas cumplen distintas funciones como la protección mecánica y química de los microorganismos, mejorar las tasas de supervivencia o la creación de un entorno óptimo para el intercambio de ADN.
¿Dónde se encuentran las biopelículas bacterianas?
En el ser humano, las biopelículas las podemos encontrar adheridas a cualquier tipo de tejido, como, por ejemplo, los dientes. De esta manera, los microorganismos que las forman tienen un mejor acceso a los nutrientes necesarios para su supervivencia.

Bibliografía
- Brauner, A., Fridman, O., Gefen, O. et al. Distinguishing between resistance, tolerance and persistence to antibiotic treatment. Nat Rev Microbiol 14, 320–330 (2016). https://doi.org/10.1038/nrmicro.2016.34
- Chun, C. K., Ozer, E. A., Welsh, M. J., Zabner, J., & Greenberg, E. P. (2004). Inactivation of a Pseudomonas aeruginosa quorum-sensing signal by human airway epithelia. Proceedings of the National Academy of Sciences of the United States of America, 101(10), 3587–3590. https://doi.org/10.1073/pnas.0308750101
- Mirzaei, R., Mohammadzadeh, R., Alikhani, M. Y., Shokri Moghadam, M., Karampoor, S., Kazemi, S., Barfipoursalar, A., & Yousefimashouf, R. (2020). The biofilm-associated bacterial infections unrelated to indwelling devices. IUBMB life, 72(7), 1271–1285. https://doi.org/10.1002/iub.2266
- Rabin, N., Zheng, Y., Opoku-Temeng, C., Du, Y., Bonsu, E., & Sintim, H. O. (2015). Biofilm formation mechanisms and targets for developing antibiofilm agents. Future medicinal chemistry, 7(4), 493–512. https://doi.org/10.4155/fmc.15.6
- Ramasubbu, N., Thomas, L. M., Ragunath, C., & Kaplan, J. B. (2005). Structural analysis of dispersin B, a biofilm-releasing glycoside hydrolase from the periodontopathogen Actinobacillus actinomycetemcomitans. Journal of molecular biology, 349(3), 475–486. https://doi.org/10.1016/j.jmb.2005.03.082
- Rendueles, O., Kaplan, JB y Ghigo, J.-M. (2013), Polisacáridos de antibiofilm. Microbiología ambiental, 15: 334-346. https://doi.org/10.1111/j.1462-2920.2012.02810.x
- Roy, R., Tiwari, M., Donelli, G., & Tiwari, V. (2018). Strategies for combating bacterial biofilms: A focus on anti-biofilm agents and their mechanisms of action. Virulence, 9(1), 522–554. https://doi.org/10.1080/21505594.2017.1313372
- Solano, C., Echeverz, M., & Lasa, I. (2014). Biofilm dispersion and quorum sensing. Current opinion in microbiology, 18, 96–104. https://doi.org/10.1016/j.mib.2014.02.008
- Tolker-Nielsen T. (2015). Biofilm Development. Microbiology spectrum, 3(2). https://doi.org/10.1128/microbiolspec.MB-0001-2014
- Yan, J., & Bassler, B. L. (2019). Surviving as a Community: Antibiotic Tolerance and Persistence in Bacterial Biofilms. Cell host & microbe, 26(1), 15–21. https://doi.org/10.1016/j.chom.2019.06.002



